Nhắc đến phản ứng oxi hóa – khử, nhiều bạn học sinh “đau đầu” vì phải ghi nhớ hàng loạt khái niệm nghe na ná nhau: chất oxi hóa, chất bị oxi hóa, rồi lại chất khử. Trong số đó, “chất bị oxi hóa” là khái niệm khiến không ít người dễ nhầm lẫn. Vậy rốt cuộc, chất bị oxi hóa là gì, có vai trò ra sao và làm thế nào để nhận biết chúng trong một phương trình hóa học? Hãy cùng The TutorX tìm hiểu chi tiết trong bài viết dưới đây!
Chất Bị Oxi Hóa Là Gì?
Trong phản ứng oxi hóa – khử, luôn có hai quá trình xảy ra song song:
- Oxi hóa: là quá trình mất electron (e⁻) → số oxi hóa tăng.
- Khử: là quá trình nhận electron (e⁻) → số oxi hóa giảm.
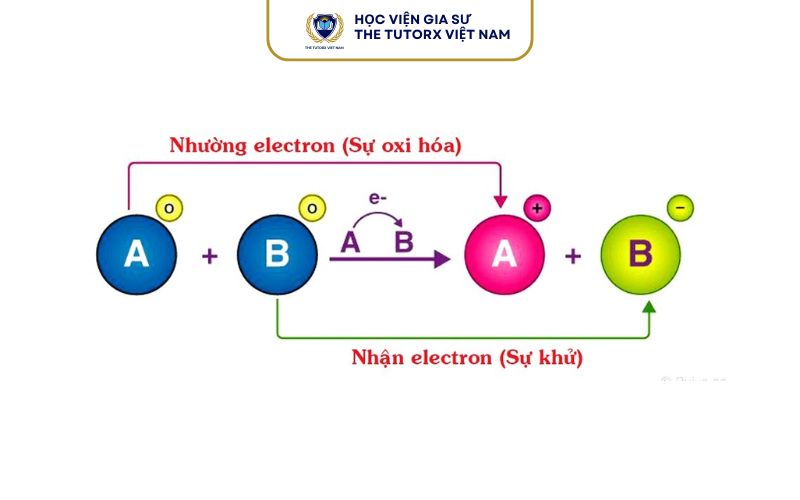
Chất bị oxi hóa chính là chất đã nhường electron cho chất khác. Lý do là khi mất electron, số oxi hóa của nó tăng lên và vì thế bị oxi hóa. Đồng thời, chất này cũng đóng vai trò là chất khử vì nó giúp chất khác nhận electron (tức là bị khử).
Thoạt nghe có vẻ nghịch lý nên không lấy làm lạ khi nhiều học sinh thắc mắc: “Tại sao chất bị oxi hóa lại là chất khử?”. Nhưng khi nhìn từ bản chất sự trao đổi electron, ta thấy điều này hoàn toàn hợp lý.
Ngoài ra, cần lưu ý rằng “bị oxi hóa” không có nghĩa là phải phản ứng với nguyên tố oxi. Điều cốt lõi ở đây là mất electron, bất kể có oxi trong phản ứng hay không.
Cách Nhận Biết Chất Bị Oxi Hóa
Chất bị oxi hóa và chất oxi hóa là cặp khái niệm thường gây nhầm lẫn. The TutorX sẽ bật mí một số mẹo đơn giản để nhanh chóng xác định được chất bị oxi hóa như sau:
Thứ nhất, quan sát sự thay đổi số oxi hóa: Sau phản ứng, chất nào có số oxi hóa tăng thì chất đó là chất bị oxi hóa.
Thứ hai, dựa vào hóa trị của nguyên tố: Nguyên tố có hóa trị tăng trong sản phẩm so với chất ban đầu thường là chất bị oxi hóa (ví dụ: Fe²⁺ → Fe³⁺).
Thứ ba, nhận biết qua bản chất kim loại – phi kim: Hầu hết kim loại (như Na, Mg, Zn) dễ mất electron nên thường là chất bị oxi hóa nhưng không phải tất cả.

Ví Dụ Dễ Hiểu Về Chất Bị Oxi Hóa
Ví dụ 1: Fe + CuSO4 → FeSO4 + Cu
Phân tích:
- Fe (sắt) từ Fe⁰ → Fe²⁺: tăng số oxi hóa, nhường 2e⁻
→ Fe là chất bị oxi hóa
→ Fe là chất khử - Cu²⁺ từ Cu²⁺ → Cu⁰: nhận 2e⁻ → giảm số oxi hóa
→ Cu²⁺ là chất oxi hóa
Ví dụ 2: 2Mg + O2 → 2MgO
Tương tự như cách phân tích trên, ta có:
- Mg từ 0 → +2 → mất 2e⁻ → chất bị oxi hóa, chất khử
- O từ 0 → -2 → nhận 2e⁻ → chất oxi hóa
Ví dụ 3: 2Na + Cl2 → 2NaCl
Cũng tương tự như cách phân tích trên, ta có:
- Na: 0 → +1 → nhường electron → chất bị oxi hóa
- Cl: 0 → -1 → nhận electron → chất oxi hóa
Trong các ví dụ trên, chất bị oxi hóa luôn là chất nhường electron, tăng số oxi hóa và làm cho chất khác bị khử.

Bài tập luyện tập:
Câu hỏi 1:
Xác định chất bị oxi hóa trong phản ứng: Zn + 2HCl → ZnCl2 + H2
Đáp án:
- Zn là chất bị oxi hóa
- H là chất oxi hóa
Câu hỏi 2:
Chọn phát biểu đúng:
A. Chất bị oxi hóa là chất nhận electron
B. Chất bị oxi hóa là chất khử
C. Chất bị oxi hóa có số oxi hóa giảm
D. Chất bị oxi hóa không thay đổi số oxi hóa
Đáp án đúng: B
Giỏi Hóa Không Khó - Đã Có The Tutorx Lo
Khi đã hiểu “chất bị oxi hóa là gì”, bạn có thấy việc giải quyết các bài tập oxi hóa – khử sẽ trở nên nhanh và chính xác hơn rất nhiều không?
Không chỉ dừng lại ở oxi hóa – khử, nếu bạn đang gặp khó khăn trong bất kỳ chuyên đề nào như cân bằng phản ứng, nhận biết chất v.v… hãy đăng ký dịch vụ gia sư chất lượng cao của The TutorX để được hỗ trợ học tập hiệu quả và có định hướng.

Đội ngũ gia sư chuyên Hóa được tuyển chọn kỹ lưỡng sẽ mang đến những hỗ trợ cụ thể như:
- Dạy 1 kèm 1 tại nhà hoặc online, đảm bảo hiệu quả.
- Ôn tập từ cơ bản đến nâng cao, luyện thi HSG, thi THPT,...
- Lộ trình cá nhân hóa theo trình độ - mục tiêu - thời gian của học sinh.
Liên hệ ngay hotline 056 388 3979 để được tư vấn miễn phí!















![[THỨ BẢY HÀNG TUẦN] THE TUTORX WORKSHOP: VẼ TRANH CANVAS - GAM MÀU HẠNH PHÚC](http://thetutorx.vn/thumbs/110x90/2024/website-workshop/website-workshop-1/thumb-workshop-ve-tranh-2.png)

