Phương trình giữa nhôm (Al) và axit clohidric (HCl) là dạng bài quen thuộc nhưng vẫn khiến nhiều học sinh nhầm lẫn khi cân bằng. Bài viết dưới đây Gia sư giỏi The tutorX sẽ giúp bạn hiểu rõ cách cân bằng phương trình Al HCl nhanh và chính xác bằng nhiều phương pháp, kèm bài tập ứng dụng.
Phương trình hóa học Al + HCl là gì?
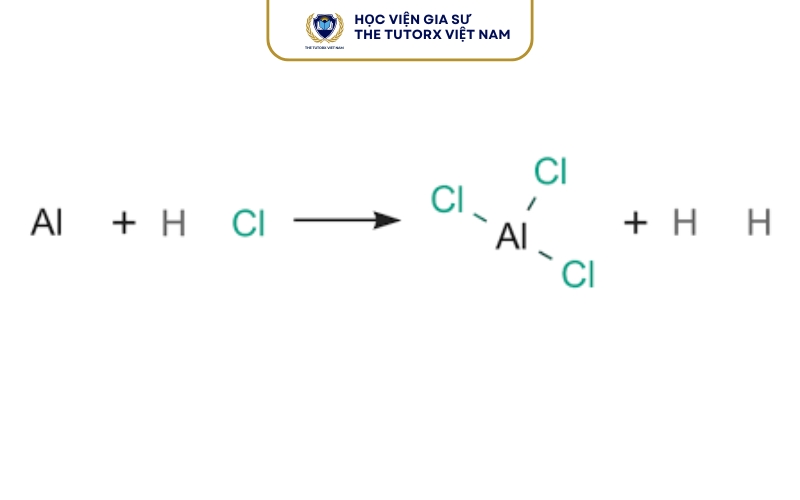
Khi kim loại nhôm (Al) tác dụng với dung dịch axit clohidric (HCl), phản ứng hóa học tạo ra muối nhôm clorua (AlCl₃) và khí hidro (H₂) thoát ra.
Phản ứng xảy ra theo dạng:
Al + HCl → AlCl₃ + H₂
Đây là phản ứng đặc trưng của kim loại đứng trước hydro trong dãy hoạt động hóa học, có khả năng đẩy H⁺ ra khỏi dung dịch axit để tạo khí H₂.
Ý nghĩa phản ứng:
- Điều chế khí hidro trong phòng thí nghiệm
- Minh họa tính khử mạnh của nhôm
- Ứng dụng trong xử lý bề mặt kim loại

Cân bằng phương trình Al HCl (Al + HCl)
Phương trình chưa cân bằng:
Al + HCl → AlCl₃ + H₂
Ta tiến hành cân bằng số nguyên tử hai vế:
- Nhôm (Al): 1 → 1 (đã cân bằng)
- Clo (Cl): 1 ở HCl → 3 ở AlCl₃ → ta cần 3 phân tử HCl
- Hydro (H): 3 H từ 3HCl → 2 H trong H₂ → cần quy đồng 2 và 3
Cách làm nhanh:
- Nhân HCl lên 6 để cân bằng đồng thời Cl và H
- Khi đó H₂ sẽ là 3 để cân bằng số H
Phương trình cân bằng đúng là: 2Al + 6HCl → 2AlCl₃ + 3H₂
Xem thêm: Dịch vụ gia sư Hóa Lớp 10 Chất Lượng Tại Nhà
Cách cân bằng Al HCl nhanh bằng phương pháp đại số
Phương pháp đại số (phương pháp hệ số) giúp cân bằng các phương trình phức tạp một cách logic, không cần thử – sai.
Bước 1: Đặt ẩn số cho từng chất
Đặt hệ số:
aAl + bHCl → cAlCl₃ + dH₂
Bước 2: Lập hệ phương trình dựa trên số nguyên tử
Với Al: a = c
Với Cl: b = 3c
Với H: b = 2d
Bước 3: Chọn 1 ẩn để giải hệ
Chọn c = 2 → a = 2
b = 3 × c = 6
6 = 2d → d = 3
Kết quả: 2Al + 6HCl → 2AlCl₃ + 3H₂
Đây là cách cân bằng nhanh, chính xác tuyệt đối cho mọi dạng phương trình.
Bài tập ứng dụng liên quan đến phương trình Al HCl
Dưới đây là một số dạng bài tập thường gặp từ phương trình Al + HCl:
Bài 1:
Cho 5,4 g Al tác dụng vừa đủ với dung dịch HCl. Tính thể tích khí H₂ (đktc) thu được.
Gợi ý:
Số mol Al = 5,4 / 27 = 0,2 mol
Theo phương trình: 2Al → 3H₂ ⇒ 1Al → 1,5H₂
nH₂ = 0,2 × 1,5 = 0,3 mol
V = 0,3 × 22,4 = 6,72 lít
Bài 2:
Cần bao nhiêu mol HCl để phản ứng hết với 0,1 mol Al?
Lời giải:
Theo phương trình: 2Al + 6HCl
→ 1Al cần 3HCl
→ 0,1 mol Al cần 0,3 mol HCl.
Bài 3:
Tính khối lượng AlCl₃ tạo thành khi cho 13,5 g Al phản ứng hoàn toàn.
Gợi ý:
nAl = 13,5/27 = 0,5 mol
tỉ lệ: 2Al → 2AlCl₃ ⇒ 1Al → 1AlCl₃
nAlCl₃ = 0,5 mol
m = 0,5 × 133,5 = 66,75 g
Phản ứng giữa Al và HCl là một trong những phương trình cơ bản nhưng lại chứa nhiều dạng bài tập vận dụng. Chỉ cần nắm vững cách cân bằng theo phương pháp đại số hoặc dựa vào quy tắc bảo toàn số nguyên tử, bạn có thể dễ dàng giải mọi bài toán liên quan. Hy vọng bài viết đã giúp bạn hiểu rõ và cân bằng phương trình Al HCl chính xác.






















![[THỨ BẢY HÀNG TUẦN] THE TUTORX WORKSHOP: VẼ TRANH CANVAS - GAM MÀU HẠNH PHÚC](https://thetutorx.vn/thumbs/110x90/2024/website-workshop/website-workshop-1/thumb-workshop-ve-tranh-2.png)


