Phản ứng giữa MnO₂ và HCl là phản ứng quen thuộc thường dùng để điều chế khí clo trong phòng thí nghiệm. Tuy nhiên, không ít học sinh gặp khó khăn khi cân bằng phương trình MnO₂ HCl hoặc chưa hiểu rõ bản chất của phản ứng này. Bài viết dưới đây Gia sư giỏi The TutorX sẽ giúp bạn nắm rõ cách cân bằng chính xác.
Điều kiện để MnO₂ tác dụng với HCl
Trước khi tiến hành cân bằng phương trình, việc đầu tiên cần quan tâm là phản ứng này chỉ xảy ra trong những điều kiện nhất định. Nếu không đảm bảo đúng điều kiện, phản ứng sẽ rất yếu hoặc hầu như không xảy ra.
- HCl phải là dung dịch đậm đặc (thường ≥ 36%).
- Phản ứng cần được đun nóng nhẹ để xảy ra nhanh và hoàn toàn.
Nếu dùng HCl loãng hoặc không đun nóng, phản ứng diễn ra rất chậm và khó quan sát hiện tượng.
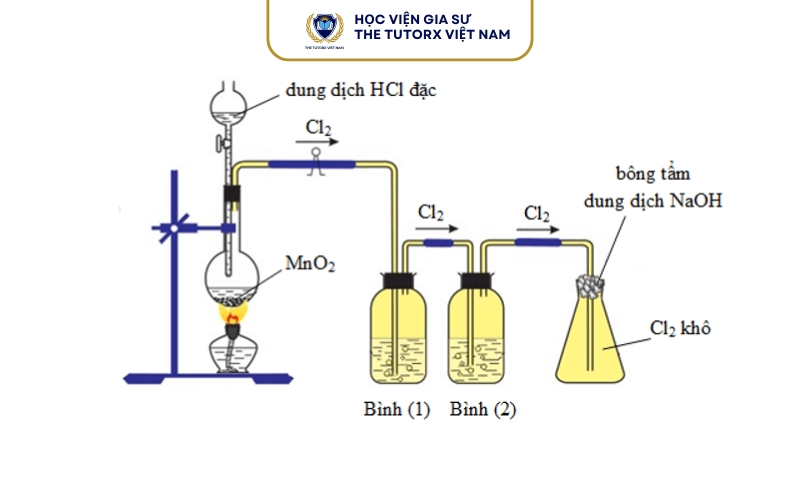
Hướng dẫn cân bằng phương trình MnO₂ HCl chi tiết
Sau khi đã nắm được điều kiện phản ứng, bước tiếp theo là tiến hành cân bằng phương trình theo đúng bản chất oxi hóa – khử của phản ứng.
Bước 1: Viết phương trình chưa cân bằng
MnO₂ + HCl → MnCl₂ + Cl₂ + H₂O
Bước 2: Xác định số oxi hóa
Mn: +4 → +2 (bị khử)
Cl: -1 → 0 (bị oxi hóa)
Bước 3: Viết quá trình oxi hóa – khử
Mn⁴⁺ + 2e → Mn²⁺
2Cl⁻ → Cl₂ + 2e
Bước 4: Hoàn chỉnh phương trình
MnO₂ + 4HCl → MnCl₂ + Cl₂ + 2H₂O
Xem thêm: Cân bằng phương trình cro3 c2h5oh chi tiết

Phương trình ion rút gọn của phản ứng MnO₂ HCl
Để hiểu rõ bản chất phản ứng trong dung dịch, ta cần chuyển phương trình phân tử sang dạng phương trình ion rút gọn, từ đó thấy được các tiểu phân thực sự tham gia phản ứng.
Phương trình ion đầy đủ:
MnO₂ + 4H⁺ + 4Cl⁻ → Mn²⁺ + 2Cl⁻ + Cl₂ + 2H₂O
Rút gọn:
MnO₂ + 4H⁺ + 2Cl⁻ → Mn²⁺ + Cl₂ + 2H₂O
Hiện tượng xảy ra khi cho MnO₂ phản ứng với HCl
Bên cạnh phương trình hóa học, việc quan sát hiện tượng thực tế giúp người học nhận biết phản ứng và ghi nhớ kiến thức lâu hơn.
Khi cho MnO₂ vào dung dịch HCl đặc và đun nóng nhẹ, ta thấy:
- Xuất hiện khí màu vàng lục (Cl₂).
- Khí có mùi hắc, gây sặc mạnh.
- MnO₂ rắn tan dần.
- Dung dịch chuyển sang màu hồng nhạt của ion Mn²⁺.
Lưu ý: Clo là khí độc, cần thao tác trong tủ hút hoặc nơi thông thoáng.
Xem thêm: Dịch vụ gia sư hóa lớp 10 chất lượng

Một số bài tập vận dụng liên quan đến MnO₂ và HCl
Để củng cố kiến thức vừa học, bạn nên luyện thêm một số bài tập vận dụng sau đây.
Bài 1
Cho 8,7 g MnO₂ phản ứng hoàn toàn với HCl dư. Tính thể tích Cl₂ thu được (đktc).
n(MnO₂) = 8,7 / 87 = 0,1 mol → n(Cl₂) = 0,1 mol → V = 2,24 lít.
Bài 2
Tính khối lượng HCl cần dùng để phản ứng hết 0,2 mol MnO₂.
n(HCl) = 4 × 0,2 = 0,8 mol → m(HCl) = 29,2 g.
Qua bài viết, bạn đã nắm được điều kiện phản ứng, cách cân bằng, phương trình ion rút gọn, hiện tượng và cách vận dụng của phản ứng giữa MnO₂ và HCl. Việc cân bằng phương trình MnO₂ HCl chính xác giúp bạn hiểu rõ bản chất phản ứng oxi hóa – khử và làm tốt các dạng bài liên quan.






















![[THỨ BẢY HÀNG TUẦN] THE TUTORX WORKSHOP: VẼ TRANH CANVAS - GAM MÀU HẠNH PHÚC](https://thetutorx.vn/thumbs/110x90/2024/website-workshop/website-workshop-1/thumb-workshop-ve-tranh-2.png)


