Viết phương trình phản ứng hóa học là một kỹ năng nền tảng nhưng không phải học sinh nào cũng thực sự nắm vững. Trong bài viết này, The TutorX sẽ hướng dẫn cách viết phương trình phản ứng hóa học một cách chính xác, dễ nhớ và áp dụng được ngay trong học tập cũng như ôn thi.
Các Bước Viết Phương Trình Phản Ứng Hóa Học
Bước 1: Xác Định Chất Tham Gia Phản Ứng
Chất tham gia phản ứng (hay còn gọi là chất phản ứng) là những chất ban đầu có mặt trước khi xảy ra phản ứng. Chất tham gia phản ứng thường là dữ kiện được cung cấp sẵn trong đề bài.

Bước 2: Dự Đoán Sản Phẩm Của Phản Ứng
Sản phẩm là chất được tạo thành sau phản ứng. Việc dự đoán sản phẩm không thể làm một cách tùy tiện mà phải dựa trên quy tắc.
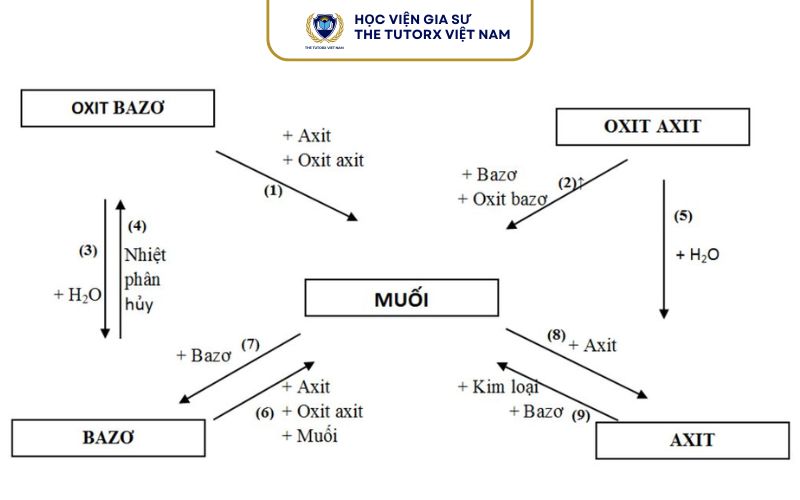
Một số quy tắc thường gặp để xác định sản phẩm:
Oxit bazơ + Oxit axit → Muối
Oxit bazơ + Axit → Muối + Nước
Oxit bazơ tan + Nước → Bazơ (kiềm)
Oxit axit + Bazơ → Muối + Nước
Oxit axit + Nước → Axit
Axit + Bazơ → Muối + Nước
Axit + Muối → Muối mới + Axit mới
Bazơ + Muối → Muối mới + Bazơ mới
Kim loại + Axit → Muối + H₂↑ (nếu kim loại đứng trước H)
Kim loại + Dung dịch muối → Muối mới + Kim loại mới
Muối + Muối → Muối mới + Muối mới
Bước 3: Viết Sơ Đồ Phản Ứng
Sau khi xác định rõ chất tham gia và sản phẩm, tiến hành viết sơ đồ phản ứng dưới dạng công thức hóa học.
Bước 4: Cân Bằng Phương Trình
Sau khi đã viết sơ đồ phản ứng, bước tiếp theo là cân bằng phương trình hóa học. Mục tiêu là đảm bảo số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau, đúng với định luật bảo toàn khối lượng.
Sau khi cân bằng, viết lại phương trình với hệ số đã điều chỉnh.

Lưu Ý Khi Viết Phương Trình Phản Ứng Hóa Học
Khi viết phương trình phản ứng hóa học, ngoài việc xác định đúng chất phản ứng và sản phẩm, bạn cần lưu ý sử dụng đầy đủ và chính xác các ký hiệu hóa học để thể hiện bản chất và tính thực tiễn của phản ứng đó.
Ký Hiệu Trạng Thái Vật Chất
Trong phương trình, trạng thái của các chất được thể hiện dưới dạng chữ viết tắt trong ngoặc hoặc ký hiệu mũi tên:
| Trạng thái | Ký hiệu |
| Rắn | (r) |
| Lỏng | (l) |
| Khí | (k) |
| Dung dịch | (dd) |
| Kết tủa | ↓ |
| Bay hơi | ↑ |
Ký Hiệu Điều Kiện Phản Ứng
Đôi khi, phản ứng chỉ xảy ra khi có điều kiện đặc biệt. Các điều kiện này được viết phía trên hoặc dưới mũi tên phản ứng.
Dưới đây là các điều kiện phản ứng phổ biến và ký hiệu tương ứng:
| Điều kiện phản ứng | Ký hiệu |
| Nhiệt độ | to, Δ |
| Áp xuất | p |
| Chất xúc tác | Tên chất cụ thể |
Ký Hiệu Chiều Phản Ứng
Ký hiệu chiều phản ứng cho biết phản ứng xảy ra theo chiều nào.
| Chiều phản ứng | Ký hiệu |
| Một chiều | → |
| Hai chiều (thuận nghịch) | ⇌ hoặc ⇄ |
Lưu ý: Không dùng mũi tên ← để biểu thị phản ứng nếu là phản ứng một chiều.
Ví Dụ Cách Viết Phương Trình Phản Ứng Hóa Học
Đề bài: Cho kẽm (Zn) tác dụng với dung dịch axit clohidric (HCl). Hãy viết phương trình phản ứng hóa học.
Bước 1: Xác định chất tham gia phản ứng
Chất tham gia gồm:
- Kẽm (Zn) – kim loại
- Axit clohidric (HCl) – dung dịch axit
Bước 2: Dự đoán sản phẩm
Theo quy tắc: Kim loại + Axit → Muối + Khí hidro (H₂↑)
Vậy sản phẩm thu được là:
- Muối kẽm clorua (ZnCl₂)
- Khí hidro (H₂↑)
Bước 3: Viết sơ đồ phản ứng
Zn + HCl → ZnCl₂ + H₂↑
Bước 4: Cân bằng phương trình
Zn + 2HCl → ZnCl₂ + H₂↑
Vừa rồi là toàn bộ hướng dẫn về cách viết phương trình phản ứng hóa học. Nếu học sinh cần được hướng dẫn kỹ hơn, học theo lộ trình cá nhân hóa hoặc ôn luyện bài bản cùng giáo viên giàu kinh nghiệm, The TutorX chính là lựa chọn đáng tin cậy.
Dịch vụ gia sư chất lượng cao của chúng tôi sẽ giúp học sinh nắm vững kiến thức Hóa học, tiến bộ rõ rệt qua từng buổi học.
Đừng ngần ngại kết nối với The TutorX qua hotline 056 388 3979 để bắt đầu hành trình học tập hiệu quả ngay hôm nay!


















![[THỨ BẢY HÀNG TUẦN] THE TUTORX WORKSHOP: VẼ TRANH CANVAS - GAM MÀU HẠNH PHÚC](https://thetutorx.vn/thumbs/110x90/2024/website-workshop/website-workshop-1/thumb-workshop-ve-tranh-2.png)


