Cân bằng phương trình ion là kỹ năng cơ bản trong hóa học, giúp bạn hiểu rõ cơ chế phản ứng và thực hiện các phép tính chính xác. Bài viết này Gia sư giỏi The TutorX sẽ hướng dẫn chi tiết các bước cân bằng phương trình ion kèm ví dụ minh họa dễ hiểu, giúp bạn nắm vững cách cân bằng phương trình ion một cách nhanh chóng và hiệu quả.
Nguyên tắc cân bằng phương trình ion
Trước khi tiến hành cân bằng phương trình ion, bạn cần nắm vững một số nguyên tắc cơ bản:
- Bảo toàn nguyên tử: Trong bất kỳ phản ứng hóa học nào, số lượng nguyên tử của mỗi nguyên tố ở hai vế của phương trình phải bằng nhau
- Bảo toàn điện tích: Phương trình ion phải cân bằng về điện tích. Tổng điện tích các ion ở vế trái phải bằng tổng điện tích các ion ở vế phải.
- Chỉ cân bằng các ion tham gia phản ứng: Đối với phương trình ion rút gọn, chỉ cân bằng các ion thực sự tham gia phản ứng. Các ion không tham gia vào phản ứng nên không cần cân bằng.
- Phương pháp từng bước: Cân bằng nguyên tử trước, sau đó cân bằng điện tích, và cuối cùng kiểm tra lại tổng số nguyên tử và điện tích.

Các bước cân bằng phương trình ion rút gọn
Phương trình ion rút gọn chỉ hiển thị các ion thực sự tham gia phản ứng. Các bước để cân bằng phương trình ion rút gọn như sau:
Viết phương trình ion đầy đủ:
Chia các hợp chất tan trong nước thành các ion của chúng. Ví dụ:
Na2SO4 + BaCl → 2NaCl + BaSO4
Viết dưới dạng ion:
2Na++ SO42- + Ba2++ 2Cl- → 2Na+ + 2Cl- + BaSO4
Các ion không thay đổi trong phản ứng là: Na+ và Cl-
Chỉ giữ lại các ion tham gia phản ứng: SO42- + Ba2+→ BaSO4
Kiểm tra cân bằng:
- Số lượng nguyên tử Ba và S bằng nhau.
- Điện tích tổng ở vế trái = 2+ - 2 = 0; vế phải cũng là 0.
Như vậy phương trình đã cân bằng.
Xem thêm: Dịch vụ gia sư hóa lớp 12 chất lượng
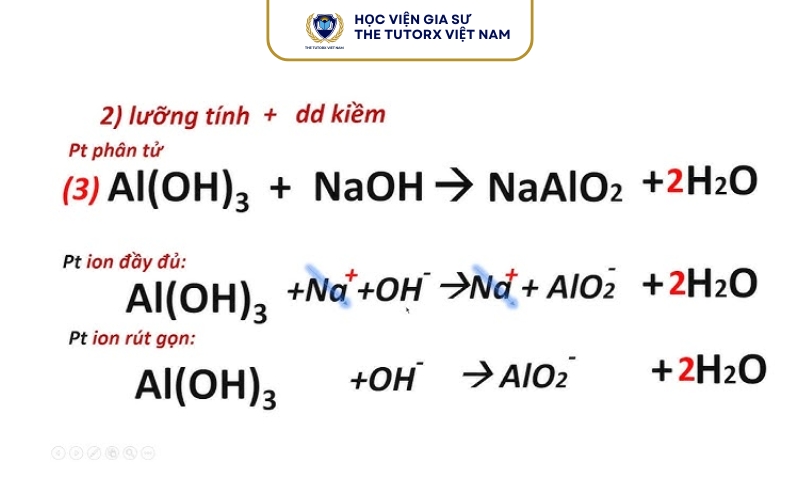
Các bước cân bằng phương trình Oxi hóa -khử
Đối với phản ứng oxi hóa – khử, cân bằng phương trình ion phức tạp hơn vì liên quan đến chuyển electron. Các bước thực hiện như sau:
Xác định số oxi hóa: Xác định nguyên tố nào bị oxi hóa và nguyên tố nào bị khử.
Viết nửa phương trình oxi hóa và khử:
Tách phản ứng thành hai nửa phản ứng:
- Nửa phản ứng oxi hóa: mất electron
- Nửa phản ứng khử: nhận electron
Cân bằng nguyên tử:
- Cân bằng các nguyên tử trừ H và O.
- Cân bằng O bằng H₂O.
- Cân bằng H bằng H⁺ (trong môi trường axit) hoặc OH⁻ (trong môi trường bazơ).
Cân bằng electron: Đảm bảo số electron mất trong phản ứng oxi hóa bằng số electron nhận trong phản ứng khử.
Cộng hai nửa phương trình lại: Sau khi cân bằng electron, cộng hai nửa phương trình để ra phương trình ion rút gọn cuối cùng.
Ví dụ minh họa cân bằng phương trình ion
Ví dụ 1: Phản ứng trao đổi ion
AgNO3 + NaCl → AgCl + NaNO3
Viết phương trình ion đầy đủ:
Ag+ + NO3- + Na+ + Cl- → AgCl + Na+ + NO3-
Phương trình rút gọn: Ag+ + Cl- → AgCl
Ví dụ 2: Phản ứng oxi hóa – khử
MnO4- + Fe2+ → Mn2+ Fe3+
- Nửa phản ứng oxi hóa: Fe2+ → Fe3+ e-
- Nửa phản ứng khử: MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
- Cân bằng electron: nhân nửa phản ứng oxi hóa với 5 để số electron bằng nhau
- Cộng lại:
5Fe2++ MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Qua các bước trên, bạn đã nắm được cách cân bằng phương trình ion một cách chi tiết, từ phương trình rút gọn đến phương trình oxi hóa – khử. Bằng cách tuân theo nguyên tắc bảo toàn nguyên tử và điện tích, kết hợp các bước rút gọn và oxi hóa – khử, bạn sẽ dễ dàng giải quyết mọi phương trình ion một cách chính xác.






















![[THỨ BẢY HÀNG TUẦN] THE TUTORX WORKSHOP: VẼ TRANH CANVAS - GAM MÀU HẠNH PHÚC](https://thetutorx.vn/thumbs/110x90/2024/website-workshop/website-workshop-1/thumb-workshop-ve-tranh-2.png)


